El politetrafluoroetileno (politetrafluoroetileno) es probablemente el fluoropolímero más utilizado porque tiene varias características que lo convierten en un material ideal para una amplia gama de aplicaciones.Es más flexible que otras tuberías similares y puede resistir casi todos los productos químicos industriales.
El rango de temperatura es de aproximadamente -330 °F a 500 °F, lo que proporciona el rango de temperatura más amplio entre los fluoropolímeros.Además, tiene excelentes propiedades eléctricas y baja permeabilidad magnética.Los tubos de PTFE son los tubos de laboratorio más utilizados y las aplicaciones en las que la resistencia química y la pureza son esenciales.PTFETiene un coeficiente de fricción muy bajo y es una de las sustancias más "deslizantes" conocidas.
Características:
Resina de PTFE 100% pura
En comparación con FEP, PFA, HP PFA, UHP PFA, ETFE, ECTFE, la mayoría de las tuberías de fluoropolímero flexibles.
Químicamente inerte, resistente a casi todos los productos químicos y disolventes industriales.
Amplio rango de temperatura
Baja penetración
Acabado superficial liso y antiadherente
Coeficiente de fricción más bajo
Excelente rendimiento eléctrico
No es inflamable
No tóxico
Aplicaciones:
laboratorio
Proceso quimico
Equipos de análisis y proceso.
Monitoreo de emisiones
Baja temperatura
alta temperatura
Electricidad
ozono
La estructura de las moléculas de PTFE.
El politetrafluoroetileno (PTFE) se produce mediante la polimerización de muchas moléculas de tetrafluoroetileno.
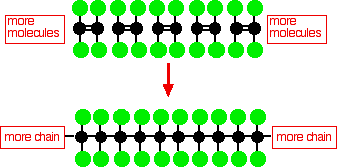
Este sencillo diagrama de PTFE no muestra la estructura tridimensional de la molécula.En el polietileno molecular más simple, la columna vertebral de carbono de la molécula está conectada sólo por átomos de hidrógeno, y esta cadena es muy flexible; definitivamente no es una molécula lineal.
Sin embargo, en el politetrafluoroetileno, el átomo de flúor en un grupo CF2 es lo suficientemente grande como para interferir con el átomo de flúor del grupo adyacente.Hay que recordar que cada átomo de flúor tiene 3 pares de electrones solitarios que sobresalen.
El efecto de esto es suprimir la rotación del enlace simple carbono-carbono.Los átomos de flúor tienden a estar dispuestos lo más lejos posible de los átomos de flúor adyacentes.La rotación tiende a implicar colisiones de pares solitarios entre átomos de flúor sobre átomos de carbono adyacentes, lo que hace que la rotación sea energéticamente desfavorable.
La fuerza repulsiva bloquea la molécula en forma de varilla y los átomos de flúor están dispuestos en una espiral muy suave: los átomos de flúor están dispuestos en espiral alrededor de la columna vertebral del carbono.Estas tiras de plomo se apretarán como lápices largos y delgados en una caja.
Esta disposición de contacto cercano tiene una influencia importante en las fuerzas intermoleculares, como verá
Fuerzas intermoleculares y punto de fusión del PTFE.
El punto de fusión del politetrafluoroetileno se estima en 327°C.Esto es bastante alto para este polímero, por lo que debe haber fuerzas de van der Waals considerables entre las moléculas.
¿Por qué la gente afirma que las fuerzas de Van der Waals en el PTFE son débiles?
La fuerza de dispersión de van der Waals es causada por los dipolos fluctuantes temporales generados cuando los electrones de la molécula se mueven.Debido a que la molécula de PTFE es grande, se esperaría una fuerza de dispersión grande porque hay muchos electrones que pueden moverse.
La situación general es que cuanto más grande es la molécula, mayor es el poder de dispersión.
Sin embargo, el PTFE tiene un problema.El flúor es muy electronegativo.Tiende a unir estrechamente los electrones del enlace carbono-flúor, con tanta fuerza que los electrones no pueden moverse como crees.Describimos que el enlace carbono-flúor no tiene una fuerte polarización.
Las fuerzas de Van der Waals también incluyen interacciones dipolo-dipolo.Pero en el politetrafluoroetileno (PTFE), cada molécula está rodeada por una capa de átomos de flúor ligeramente cargados negativamente.En este caso, ¡la única interacción posible entre moléculas es la repulsión mutua!
Entonces, la fuerza de dispersión es más débil de lo que piensas y la interacción dipolo-dipolo provocará repulsión.No es de extrañar que la gente diga que la fuerza de Van der Waals en el PTFE es muy débil.En realidad no obtendrás la fuerza repulsiva, porque la influencia de la fuerza de dispersión es mayor que la de la interacción dipolo-dipolo, pero el efecto neto es que la fuerza de Van der Waals tenderá a debilitarse.
Pero el PTFE tiene un punto de fusión muy alto, por lo que la fuerza que mantiene unidas las moléculas debe ser muy fuerte.
¿Cómo puede el PTFE tener un alto punto de fusión?
El PTFE es muy cristalino, en este sentido tiene una gran superficie, las moléculas están en una disposición muy regular.Recuerde, las moléculas de PTFE pueden considerarse como varillas alargadas.Estos polos estarán muy agrupados
Esto significa que, aunque la molécula de ptfe no puede producir dipolos temporales realmente grandes, los dipolos se pueden utilizar de manera muy eficiente.
Entonces, ¿las fuerzas de Van der Waals en el PTFE son débiles o fuertes?
¡Creo que ambos pueden tener razón!Si las cadenas de politetrafluoroetileno (PTFE) se disponen de tal manera que no haya un contacto demasiado estrecho entre las cadenas, la fuerza entre ellas será muy débil y el punto de fusión será muy bajo.
Pero en el mundo real, las moléculas están en estrecho contacto.Las fuerzas de Van der Waals pueden no ser tan poderosas como podrían ser, pero la estructura del PTFE significa que sienten el mayor efecto, produciendo fuertes enlaces intermoleculares en general y altos puntos de fusión.
Esto contrasta con otras fuerzas, como la fuerza de interacción dipolo-dipolo, que sólo se reduce 23 veces, o la distancia se reduce al doble, 8 veces.
Por lo tanto, el empaquetamiento apretado de moléculas en forma de varilla en PTFE maximiza la efectividad de la dispersión.
Las propiedades antiadherentes
Esta es la razón por la que el agua y el aceite no se pegan a la superficie del PTFE y por qué se pueden freír huevos en una sartén recubierta de PTFE sin que se peguen a la sartén.
Es necesario considerar qué fuerzas podrían fijar otras moléculas en la superficie dePTFE.Puede incluir algún tipo de enlace químico, fuerza de van der Waals o enlace de hidrógeno.
Enlace químico
El enlace carbono-flúor es muy fuerte y es imposible que otras moléculas alcancen la cadena de carbono para provocar una reacción de sustitución.Es imposible que se produzca un enlace químico.
las fuerzas de van der Waals
Hemos visto que la fuerza de van der Waals en el PTFE no es muy fuerte y sólo hará que el PTFE tenga un punto de fusión alto, porque las moléculas están tan cerca que tienen un contacto muy efectivo.
Pero la situación es diferente para otras moléculas cercanas a la superficie del PTFE.Las moléculas relativamente pequeñas (como las moléculas de agua o de aceite) solo tendrán una pequeña cantidad de contacto con la superficie y solo se generará una pequeña cantidad de atracción de van der Waals.
Una molécula grande (como una proteína) no tendrá forma de varilla, por lo que no hay suficiente contacto efectivo entre ella y la superficie para superar la baja tendencia a la polarización del PTFE.
De cualquier manera, la fuerza de Van der Waals entre la superficie del PTFE y los elementos circundantes es pequeña e ineficaz.
Enlaces de hidrógeno
Las moléculas de PTFE de la superficie están completamente envueltas por átomos de flúor.Estos átomos de flúor son muy electronegativos, por lo que todos llevan un cierto grado de carga negativa.Cada flúor también tiene 3 pares de electrones solitarios que sobresalen.
Estas son las condiciones necesarias para la formación de enlaces de hidrógeno, como el par solitario del flúor y el átomo de hidrógeno del agua.Pero esto obviamente no sucederá, de lo contrario habrá una fuerte atracción entre las moléculas de PTFE y las moléculas de agua, y el agua se adherirá al PTFE.
Resumen
No existe una forma eficaz de que otras moléculas se adhieran con éxito a la superficie del PTFE, por lo que tiene una superficie antiadherente.
La baja fricción
El coeficiente de fricción del PTFE es muy bajo.Esto significa que si tienes una superficie recubierta con ptfe, otras cosas se deslizarán fácilmente sobre ella.
A continuación se muestra un breve resumen de lo que está sucediendo.Esto proviene de un artículo de 1992 titulado "Fricción y desgaste del politetrafluoroetileno".
Al inicio del deslizamiento, la superficie de PTFE se rompe y la masa se transfiere hacia donde se desliza.Esto significa que la superficie de PTFE se desgastará.
A medida que continuaba el deslizamiento, los bloques se desplegaron formando finas películas.
Al mismo tiempo, se retira la superficie del PTFE para formar una capa organizada.
Ambas superficies en contacto ahora tienen moléculas de PTFE bien organizadas que pueden deslizarse entre sí.
Lo anterior es la introducción del politetrafluoroetileno, el politetrafluoroetileno se puede convertir en una variedad de productos, estamos especializados en la fabricación de tubos de ptfe.fabricantes de mangueras de ptfe, bienvenido a comunicarse con nosotros
Búsquedas relacionadas con manguera de ptfe:
Hora de publicación: 05-mayo-2021





