Politetrafluoretilena (politetrafluoretilena) este probabil cel mai utilizat fluoropolimer deoarece are mai multe caracteristici care îl fac un material ideal pentru o gamă largă de aplicații.Este mai flexibil decât alte țevi similare și poate rezista aproape tuturor substanțelor chimice industriale
Intervalul de temperatură este de aproximativ -330°F până la 500°F, oferind cel mai larg interval de temperatură dintre fluoropolimeri.În plus, are proprietăți electrice excelente și permeabilitate magnetică scăzută.Tubul din Ptfe este cel mai utilizat tub de laborator și aplicații în care rezistența chimică și puritatea sunt esențiale.PTFEare un coeficient de frecare foarte scăzut și este una dintre cele mai „alunecare” substanțe cunoscute
Caracteristici:
Rășină PTFE 100% pură
În comparație cu FEP, PFA, HP PFA, UHP PFA, ETFE, ECTFE, cele mai flexibile țevi de fluoropolimer
Inert din punct de vedere chimic, rezistent la aproape toate substanțele chimice industriale și solvenții
Gamă largă de temperatură
Penetrare scăzută
Finisaj neted de suprafață, antiaderent
Cel mai mic coeficient de frecare
Performanță electrică excelentă
Neinflamabil
Non-toxic
Aplicatii:
laborator
Proces chimic
Echipamente de analiză și proces
Monitorizarea emisiilor
Temperatura scazuta
temperatura ridicata
Electricitate
ozon
Structura moleculelor de PTFE
Politetrafluoretilena (PTFE) este obținută prin polimerizarea multor molecule de tetrafluoretilenă
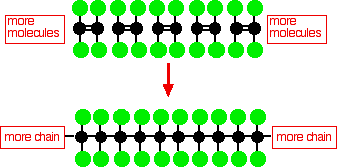
Această diagramă simplă de PTFE nu arată structura tridimensională a moleculei.În polietilena moleculară mai simplă, coloana vertebrală de carbon a moleculei este conectată numai prin atomi de hidrogen, iar acest lanț este foarte flexibil - cu siguranță nu este o moleculă liniară
Cu toate acestea, în politetrafluoretilenă, atomul de fluor dintr-o grupă CF2 este suficient de mare pentru a interfera cu atomul de fluor din grupul adiacent.Trebuie să vă amintiți că fiecare atom de fluor are 3 perechi de electroni singuri care ies în afară
Efectul acestui lucru este de a suprima rotația legăturii simple carbon-carbon.Atomii de fluor tind să fie aranjați astfel încât să fie cât mai departe posibil de atomii de fluor adiacenți.Rotația tinde să implice ciocniri de perechi singure între atomii de fluor pe atomii de carbon adiacenți - ceea ce face ca rotația să fie nefavorabilă din punct de vedere energetic.
Forța de respingere blochează molecula într-o formă de tijă, iar atomii de fluor sunt aranjați într-o spirală foarte blândă - atomii de fluor sunt aranjați într-o spirală în jurul coloanei vertebrale de carbon.Aceste benzi de plumb vor fi strânse împreună ca niște creioane lungi și subțiri într-o cutie
Acest aranjament de contact strâns are o influență importantă asupra forțelor intermoleculare, după cum veți vedea
Forțele intermoleculare și punctul de topire al PTFE
Punctul de topire al politetrafluoretilenei este de 327°C.Acest lucru este destul de mare pentru acest polimer, așa că trebuie să existe forțe Van der Waals considerabile între molecule
De ce susțin oamenii că forțele van der Waals din PTFE sunt slabe?
Forța de dispersie van der Waals este cauzată de dipolii fluctuanți temporari generați atunci când electronii din moleculă se mișcă.Deoarece molecula de PTFE este mare, te-ai aștepta la o forță de dispersie mare, deoarece există o mulțime de electroni care se pot mișca
Situația generală este că cu cât molecula este mai mare, cu atât puterea de dispersie este mai mare
Cu toate acestea, PTFE are o problemă.Fluorul este foarte electronegativ.Are tendința de a lega strâns electronii din legătura carbon-fluor, atât de strâns încât electronii nu se pot mișca așa cum credeți.Descriem legătura carbon-fluor ca neavând polarizare puternică
Forțele Van der Waals includ și interacțiunile dipol-dipol.Dar în politetrafluoretilenă (PTFE), fiecare moleculă este înconjurată de un strat de atomi de fluor ușor încărcați negativ.În acest caz, singura interacțiune posibilă între molecule este repulsia reciprocă!
Deci forța de dispersie este mai slabă decât credeți, iar interacțiunea dipol-dipol va provoca repulsie.Nu e de mirare că oamenii spun că forța van der Waals în PTFE este foarte slabă.De fapt, nu veți obține forța de respingere, deoarece influența forței de dispersie este mai mare decât cea a interacțiunii dipol-dipol, dar efectul net este că forța van der Waals va tinde să slăbească
Dar PTFE are un punct de topire foarte mare, astfel încât forța care ține moleculele împreună trebuie să fie foarte puternică
Cum poate PTFE să aibă un punct de topire ridicat?
PTFE este foarte cristalin, in acest sens exista o suprafata mare, moleculele sunt intr-un aranjament foarte regulat.Amintiți-vă, moleculele de PTFE pot fi considerate ca niște tije alungite.Acești poli vor fi strâns grupați
Aceasta înseamnă că, deși molecula de ptfe nu poate produce dipoli temporari cu adevărat mari, dipolii pot fi utilizați foarte eficient.
Deci forțele van der Waals din PTFE sunt slabe sau puternice?
Cred că puteți avea dreptate amândoi!Dacă lanțurile din politetrafluoretilenă (PTFE) sunt aranjate astfel încât să nu existe un contact prea strâns între lanțuri, forța dintre ele va fi foarte slabă, iar punctul de topire va fi foarte scăzut.
Dar în lumea reală, moleculele sunt în contact strâns.Forțele Van der Waals s-ar putea să nu fie la fel de puternice pe cât ar fi, dar structura PTFE înseamnă că simt cel mai mare efect, producând legături intermoleculare puternice și puncte de topire ridicate.
Acest lucru este în contrast cu alte forțe, cum ar fi forța de interacțiune dipol-dipol, care este redusă doar de 23 de ori, sau de două ori distanța este redusă de 8 ori.
Prin urmare, ambalarea strânsă a moleculelor în formă de tijă în PTFE maximizează eficacitatea dispersiei
Proprietățile antiaderente
Acesta este motivul pentru care apa și uleiul nu se lipesc de suprafața PTFE și de ce puteți prăji ouăle într-o tigaie acoperită cu PTFE fără să se lipească de tigaie.
Trebuie să luați în considerare ce forțe ar putea fixa alte molecule de pe suprafațaPTFE.Poate include un fel de legătură chimică, forță van der Waals sau legătură de hidrogen
Legături chimice
Legătura carbon-fluor este foarte puternică și este imposibil ca orice alte molecule să ajungă în lanțul de carbon pentru a provoca orice reacție de substituție.Este imposibil să apară o legătură chimică
forțele van der Waals
Am văzut că forța van der Waals în PTFE nu este foarte puternică și va face doar ca PTFE să aibă un punct de topire ridicat, deoarece moleculele sunt atât de apropiate încât au un contact foarte eficient.
Dar este diferit pentru alte molecule apropiate de suprafața PTFE.Moleculele relativ mici (cum ar fi moleculele de apă sau moleculele de ulei) vor avea doar o cantitate mică de contact cu suprafața și va fi generată doar o cantitate mică de atracție van der Waals.
O moleculă mare (cum ar fi o proteină) nu va avea formă de tijă, așa că nu există suficient contact eficient între ea și suprafață pentru a depăși tendința de polarizare scăzută a PTFE.
Oricum, forța van der Waals dintre suprafața PTFE și lucrurile din jur este mică și ineficientă.
Legături de hidrogen
Moleculele de PTFE de la suprafață sunt complet învelite de atomi de fluor.Acești atomi de fluor sunt foarte electronegativi, așa că toți poartă un anumit grad de sarcină negativă.Fiecare fluor are, de asemenea, 3 perechi de electroni singuri proeminenti
Acestea sunt condițiile necesare pentru formarea legăturilor de hidrogen, cum ar fi perechea singură pe fluor și atomul de hidrogen din apă.Dar acest lucru evident nu se va întâmpla, altfel va exista o atracție puternică între moleculele de PTFE și moleculele de apă, iar apa se va lipi de PTFE.
rezumat
Nu există o modalitate eficientă pentru ca alte molecule să se atașeze cu succes la suprafața PTFE, deci are o suprafață antiaderentă.
Frecarea scăzută
Coeficientul de frecare al PTFE este foarte scăzut.Aceasta înseamnă că, dacă aveți o suprafață acoperită cu ptfe, alte lucruri vor aluneca ușor pe ea.
Mai jos este un rezumat rapid a ceea ce se întâmplă.Aceasta provine dintr-o lucrare din 1992 intitulată „Friction and Wear of Polytetrafluoreethylene”.
La începutul alunecării, suprafața PTFE se rupe și masa este transferată oriunde alunecă.Aceasta înseamnă că suprafața PTFE se va uza.
Pe măsură ce alunecarea a continuat, blocurile s-au desfășurat în pelicule subțiri.
În același timp, suprafața PTFE este extrasă pentru a forma un strat organizat.
Ambele suprafețe în contact au acum molecule de PTFE bine organizate care pot aluneca una pe cealaltă
Cele de mai sus este introducerea politetrafluoretilenei, politetrafluoretilena poate fi transformată într-o varietate de produse, suntem specializați în fabricarea tubului ptfe,producatori de furtunuri ptfe, bine ați venit să comunicați cu noi
Căutări referitoare la furtun ptfe:
Ora postării: mai-05-2021





